PREFACE
はじめに
新しい反応を開発し,新しい分子を創造する.先人が手にし得なかった世界初のモノを.有機合成化学には芸術や音楽のような直感に訴える魅力があると信じています.アッと驚く形式の反応,純粋に美しいと感じる形の分子,かけがえのない機能を持つ分子など,私たちが自らの手で創り出すモノが世界の仕組みを変え,暮らしを豊かにしてくれるかもしれません.また,研究に通底するこだわり・概念が未来の新常識となり,自らの成果で次世代の教科書を書き換えられるかもしれません.私たちと一緒に日々ドキドキワクワクしながら有機合成化学のフィールドを熱量いっぱいに全力疾走しませんか.心揺さぶるロックな新反応をともに開発しましょう.
RESEARCH
研究内容
アラインの合成化学 (吉田)
Synthetic Organic Chemistry with Aryne (Yoshida)
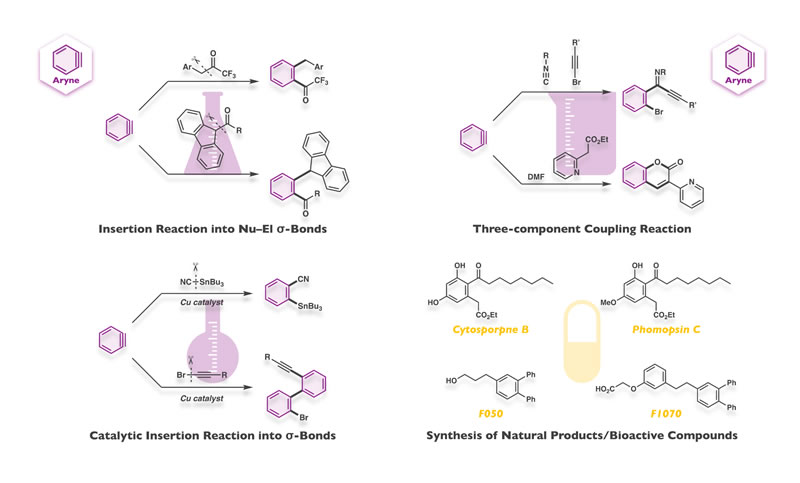
芳香環に三重結合を導入した化合物を一般にアラインと呼びます.その高度に歪んだ構造がアラインの三重結合にもたらす極めて高い求電子性を利用し,求核部−求電子部間単結合へのアライン挿入反応や,アライン・求核剤・求電子剤を繋ぐ三成分連結反応を達成しています.また,アラインを遷移金属触媒存在下元素間単結合に挿入させる反応も開発しており,多彩な多置換芳香族化合物や芳香族縮合複素環の直截合成を成し遂げています.
Compounds having a carbon–carbon triple bond on their aromatic ring are generally called as arynes. By utilizing the highly electrophilic character of arynes, arising from their extremely strained structure, we have achieved a variety of aryne insertion reactions into nucleophilic–electrophilic σ-bonds and three-component coupling reactions with nucleophiles and electrophiles, where arynes act as relay molecules. Furthermore, we have also developed transition metal-catalyzed insertion reactions of arynes into σ-bonds. All of these reactions provide direct and efficient ways of synthesizing diverse multisubstituted arenes and benzo-annulated heterocycles.
引用文献
- H. Yoshida, Y. Ito, Y. Yoshikawa, J. Ohshita, K. Takaki, Chem. Commun. 2011, 47, 8664–8666.
- H. Yoshida, T. Kishida, M. Watanabe, J. Ohshita, Chem. Commun. 2008, 5963–5965.
- H. Yoshida, Y. Asatsu, Y. Mimura, Y. Ito, J. Ohshita, K. Takaki, Angew. Chem. Int. Ed. 2011, 50, 9676–9679.
- H. Yoshida, Y. Ito, J. Ohshita, Chem. Commun. 2011, 47, 8512–8514.
- H. Yoshida, T. Kubo, H. Kuriki, I. Osaka, K. Takaki, Y. Ooyama, ChemistrySelect 2017, 2, 3212–3215.
- T. Morishita, H. Yoshida, J. Ohshita, Chem. Commun. 2010, 46, 640–642.
- H. Yoshida, T. Morishita, J. Ohshita, Chem. Lett. 2010, 39, 508–509.
ホウ素の合成化学 (吉田)
Synthetic Organic Chemistry with Boron (Yoshida)
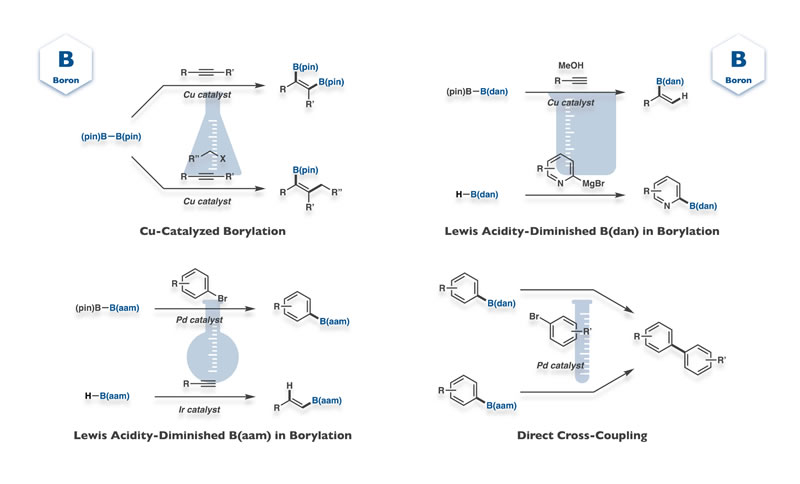
ホウ素は現代精密有機合成化学を支える花形元素といっても過言ではありません.鈴木−宮浦カップリングやヒドロホウ素化などホウ素を基調とする反応では,その進行や位置選択性にホウ素のルイス酸性が決定的役割を果たしますが,われわれは「ホウ素本来のルイス酸性を抑制する」ことで得られるユニークな反応性・選択性・化合物安定性に興味を持っています.これまでに様々なホウ素化反応を開発するとともに,得られたルイス酸性抑制有機ホウ素の直截クロスカップリングも達成しています.
Boron is an undoubtedly star element in modern synthetic organic chemistry, and its Lewis acidity decisively affects progress and regioselectivity of boron-based reactions such as Suzuki–Miyaura coupling and hydroboration. On the other hand, we have been interested in diminishing inherent boron-Lewis acidity, which leads to unique reactivity/selectivity in borylation reactions, and marked stability of organoboron compounds. We have succeeded in developing various borylation reactions and direct cross-coupling of the resulting organoboron compounds with diminished Lewis acidity.
引用文献
- H. Yoshida, S. Kawashima, Y. Takemoto, K. Okada, J. Ohshita, K. Takaki, Angew. Chem. Int. Ed. 2012, 51, 235–238.
- H. Yoshida, I. Kageyuki, K. Takaki, Org. Lett. 2013, 15, 952–955.
- H. Yoshida, Y. Takemoto, K. Takaki, Chem. Commun. 2014, 50, 8299–8303.
- J. Li, M. Seki, S. Kamio, H. Yoshida, Chem. Commun. 2020, 56, 6388–6391.
- S. Kamio, I. Kageyuki, I. Osaka, S. Hatano, M. Abe, H. Yoshida, Chem. Commun. 2018, 54, 9290–9293.
- H. Yoshida, M. Kimura, H. Tanaka, Y. Murashige, I. Kageyuki, I. Osaka, Chem. Commun. 2019, 55, 5420–5422.
- H. Yoshida, M. Seki, S. Kamio, H. Tanaka, Y. Izumi, J. Li, I. Osaka, M. Abe, H. Andoh, T. Yajima, T. Tani, T. Tsuchimoto, ACS Catal. 2020, 10, 346–351.
- S. Kamio, I. Kageyuki, I. Osaka, H. Yoshida, Chem. Commun. 2019, 55, 2624–2627.
スズの合成化学 (吉田)
Synthetic Organic Chemistry with Tin (Yoshida)
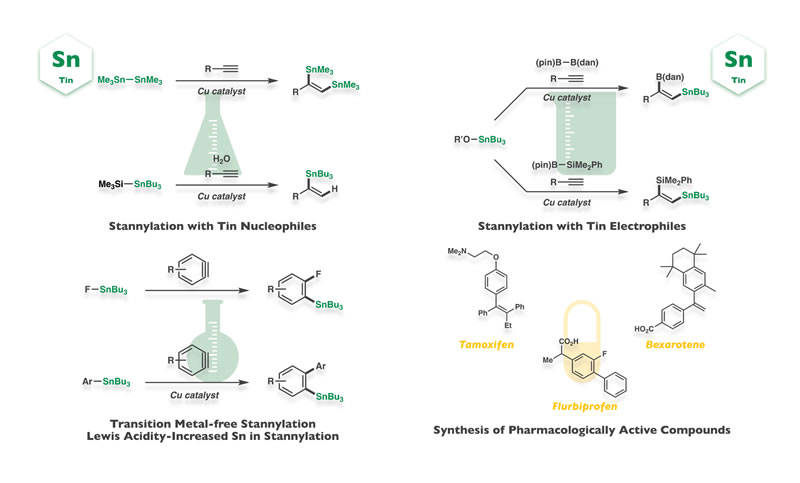
スズも現代精密有機合成化学に欠かせない元素ですが,成熟度の高いホウ素に比べるとその合成化学には未開拓なものが数多く残されていると考えています.ホウ素とは異なり,通常はルイス酸性をほとんど示さない点がスズの特長であり,これに起因するユニークな反応性・選択性に注目しています.これまでにスズを求核剤あるいは求電子剤として機能させる触媒的スタニル化反応を開発するとともに,遷移金属触媒フリーな反応も達成しています.また,スズのルイス酸性誘起を起点とするスタニル化の開発にも成功しています.
Tin is also an indispensable element in modern synthetic organic chemistry, however, its utilization still remains underdeveloped as compared with mature boron counterpart. The characteristic feature is that tin is scarcely Lewis acidic in general, which is in sharp contrast to inherently Lewis acidic boron. We have focused our attention on unique reactivity and selectivity arising from the less Lewis acidity, and have achieved a variety of catalytic stannylation reactions using tin nucleophiles or electrophiles, and transition metal-free reactions. We have also developed unique stannylation reactions depending upon increased tin-Lewis acidity.
引用文献
- H. Yoshida, A. Shinke, K. Takaki, Chem. Commun. 2013, 49, 11671–11673.
- H. Yoshida, A. Shinke, Y. Kawano, K. Takaki, Chem. Commun. 2015, 51, 10616–10619.
- H. Yoshida, Y. Takemoto, K. Takaki, Chem. Commun. 2015, 51, 6297–6300.
- H. Yoshida, Y. Hayashi, Y. Ito, K. Takaki, Chem. Commun. 2015, 51, 9440–9442.
- H. Yoshida, R. Yoshida, K. Takaki, Angew. Chem. Int. Ed. 2013, 52, 8629–8632.
- H. Tanaka, H. Kuriki, T. Kubo, I. Osaka, H. Yoshida, Chem. Commun. 2019, 55, 6503–6506.
- Y. Takemoto, H. Yoshida, K. Takaki, Chem. Eur. J. 2012, 18, 14841–14844.
高周期典型元素化合物の分子構造と反応 (中本)
Structure and Bonding of Novel Heavier Main-group Compounds (Nakamoto)
ケイ素やリンなど高周期元素の有機化学を行っています.有機元素化学の現在のテーマの一つに,元素の特性を理解して従来にはない分子構造や反応性,機能性を生み出すことがあります.そのために,第二周期元素で確立された「有機化学」をさらに高周期元素や遷移金属元素に拡張して,反応や構造の類似性,相違点を明らかにしていく研究を行っています.具体的には,典型元素からなる高歪分子や芳香族化合物,低原子価化合物,開殻分子など天然には存在しなかった分子を,速度論的安定化の手法を駆使して作り出すことを目指しています.
While organic chemistry mostly concerns about second period elements such as carbon, nitrogen and oxygen, our team is interested in heavier main-group elements that are beyond 2nd period, such as silicon and phosphorus. We use them in stabilizing highly reactive molecules, which are also structurally strained to examine their electronic properties in terms of aromaticity, valency, and spin. We are systematically investigating the structure-property relationship with these highly reactive molecules and deepens the understanding of Main Group element chemistry.

引用文献
- T. Imagawa, M. Nakamoto, R. Shang, Y. Adachi, J. Ohshita, N. Tsunoji, Y. Yamamoto, Chem. Lett. 2020, 49, 1022–1025.
- Y. Inagaki, M. Nakamoto, A. Sekiguchi, Nat. Commun. 2014, 5:3018 doi: 10.1038/ncomms4018.
- Y. Inagaki, M. Nakamoto, A. Sekiguchi, J. Am. Chem. Soc. 2011, 133, 16436–16439.
- M. Nakamoto, Y. Inagaki, M. Nishina, A. Sekiguchi, J. Am. Chem. Soc. 2009, 131, 3172–3173.

